수업후기
제6강 (2021.07.04) 노화방지의 세계(NAD world & Autophage)
#0
지난 강의에서 단백질에 아세틸기(Ac)가 붙으면 단백질-소각장에 못 간다고 하였다. 그것이 노화의 원인이다. 그럼 왜 단백질에 아세틸기가 붙는가? 세포 속에 Acetyl-CoA가 압도적으로 많기 때문에 안 부딪힐 수가 없다. 포화지방산인 팔미트산은 미토콘드리아에서 β-oxidation 과정을 통해 8분자의 acetyl-CoA가 나온다.
단백질의 분해와 결합이 잘 되어야 한다. 특히 분해가 잘 되어야 한다. 단백질 분해와 결합이 균형을 이루는 것이 단백질항상성(proteostasis)인데, 노화의 원인 중 하나가 단백질항상성의 상실(Loss of proteostasis)이다. 우리가 삼겹살을 즐기기에 acetyl-CoA가 무지하게 많이 나오고, 단백질에 아세틸기는 무조건 붙게 된다. 그러면 문제가 발생한 단백질이 소각장으로 가지 못한다. 그것이 노화이다. 누군가 아세틸기를 떼어 주어야 한다.
오토파지(Autophagy, 자가소화작용)가 2016년 노벨상을 받았다. 좋고 나쁘고 가리지 않고 모든 단백질을 소각장으로 보내서 없애주는 작용이다. 우리가 하루 먹는 단백질은 70g인데, 세포에는 240g이 생긴다. 오토파지가 다 없애고 다시 만드는 것, 이것을 이해하는 것이 세포생물학 이해하는 핵심이다. 나쁜 것만 골라서 없애는 것 보다 모두 없애고 다시 만드는 것이 더 빠르다.
Acetyl-CoA와 충돌 안할 수 없으니 단백질에 아세틸기가 붙을 수 밖에 없는데, 골라서 없애는 것이 아니라 모두 다 없애는 것이 오토파지이고, 단백질의 아세틸기를 떼어주어 NAD에 붙여 주는 것이 서투인(SIRT)이다.
최근에 노벨상을 받는 분야는 새로운 산업이 생긴다. 최근 유행하는 다이어트법인 간헐적 단식의 백업 이론이 오토파지이다. 나이가 들면 중요한 물질이 줄어든다. NAD 양도 노인은 청년에 비해 10% 밖에 안된다. 어릴 때와 나이들 때 줄어드는 물질에 주목해야 한다. NAD와 멜라토닌이 그러하다. 오토파지도 노화방지(anti-aging)법으로 깡그리 없애고 다시 만든다. 반대로 노화되면 세포에서 많아지는 단백질이 루비콘(Rubicon)이다. 루비콘을 없애면 수명이 연장된다. 루비콘은 오토파지를 억제한다. 그래서 나이들면 오토파지가 잘 안일어난다.
서투인(SIRT)은 나드세계(NAD world)이다. 모든 단백질에서 아세틸기를 무조건 떼어낸다. 그러면 단백질을 소각장으로 보낼 수 있다. 세포질, 미토콘드리아, 세포 밖의 모든 조직에서 관여한다. 분자레벨로 내려오면 하나도 안 헷갈린다. 리보오스 분자식을 그릴 수 있으면 나드세계는 오토매틱으로 쭉 나간다. 모든 생물은 동화-이화작용으로 살아가므로 분자를 붙이거나 떼내는 2가지 길 밖에 없다. 분자만 알면 하나도 어렵지 않다.
#1
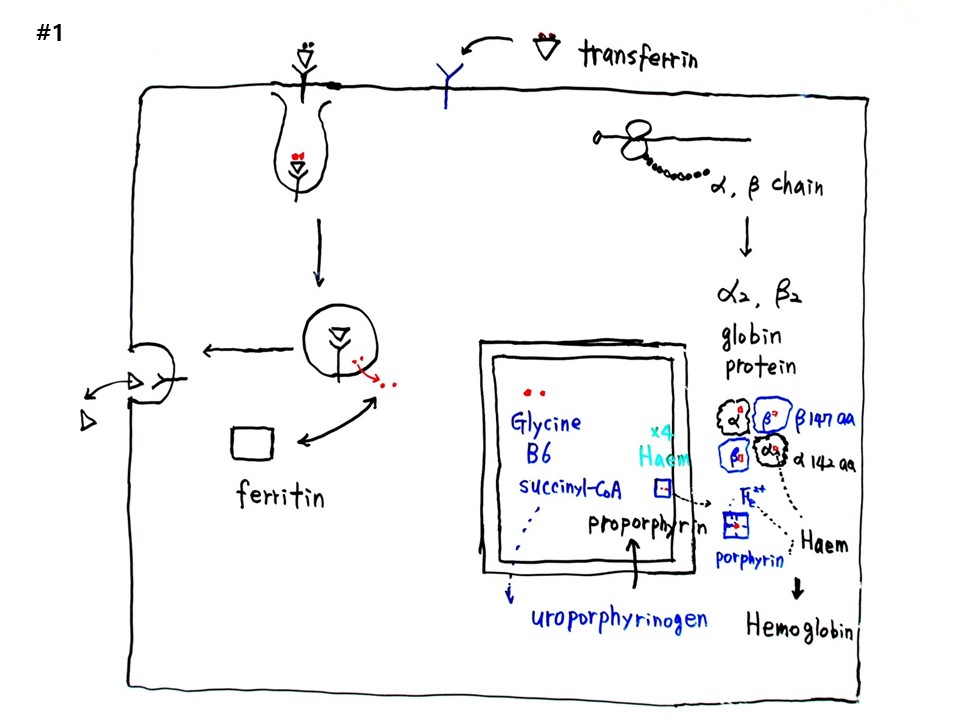
인간, 동물을 공부하고 싶을 때 200종류의 세포 중에서 1개의 세포만 공부하라고 하면 압도적으로 선택해야 하는 것이 ‘적혈구’이다. 전체 세포 숫자의 50%를 차지한다. 적혈구만 알면 세포 절반을 아는 것과 마찬가지다. 적혈구는 1초에 300만개, 하루에 3000억개가 생성된다. 그럼 공부해야 한다. 살아있다는 현상이 느껴진다. 적혈구는 다른 세포와 달리 2가지가 없는데, 핵이 없고, 미토콘드리아가 없다. 미토콘드리아가 없는 이유는 산소배달사고를 방지하기 위함이다. 있는 상태보다 없는 상태를 공부하면 더 알기가 쉽다. 우리 몸에서 살아서 체내를 이동하는 세포는 암세포와 적혈구이다.
적혈구는 결합조직에 속한다. 적혈구 속에는 압도적으로 많은 것이 헤모글로빈 단백질로 2억8천만개이다. 헤모글로빈은 α-unit가 2개, β-unit가 2개로 구성된다. 1개의 unit에 아미노산 개수가 몇 개인지 알아내려고 구글을 1시간 뒤졌다. 철(Fe)은 세포 속에서 원자단위로 볼 수 있다. Unit당 1개씩 철이 들어가므로, 헤모글로빈에 4개이다. 적혈구 세포 1개의 헤모글로빈 숫자를 대략 2억5천만개라고 하면, 4를 곱하니 적혈구 1개당 10억개의 철이 박혀있다. 철 1개는 산소분자(O2) 1개와 결합한다. 1초에 300만개 적혈구가 생성되니, 우리가 숨을 1초에 1번 들이쉰다고 하면 10억ⅹ300만= 3000조 개의 산소가 들어온다고 추산할 수 있다.
철(Fe)이 세포 속으로 들어와서 헤모글로빈으로 들어가는 과정을 그려보자. 세포막에 수용체가 있다. 철을 수송하는 transferrin 단백질이 수용체에 붙는다. 그러면 코로나바이러스처럼 endocytosis 방식으로 들어온다. 수용체와 함께 세포 내로 들어온 철 2원자는 빠져 나가서 ferritin 단백질에 흡착되어 보관되고, 남은 수용체와 transferrin 단백질은 exocytosis 되어 수용체는 세포막에 박히고 transferrin 은 세포 밖으로 나가서 재사용된다.
미토콘드리아에서 Glycine과 Succinyl-CoA는 여러경로를 거치며 선구물질인 uroporphyrinogen을 형성하고 다시 전구물질인 protoporphyrin을 거쳐서 porphyrin에 철(Fe) 1원자가 중앙에 결합하여 Heme이 된다.
mRNA를 리보솜이 읽으면 α와 β-chain을 생성하여 글로빈(globin) 단백질을 만든다. 글로빈은 α와 β unit가 2개씩 4개가 1세트이고, 각 unit에 heme이 1개씩 포함된다. 이를 헤모글로빈(hemoglobin)이라고 한다. 글로빈단백질 α unit는 142개 아미노산, β unit는 147개 아미노산으로 구성되어 헤모글로빈의 아미노산 개수는 약 500개이다.
#2
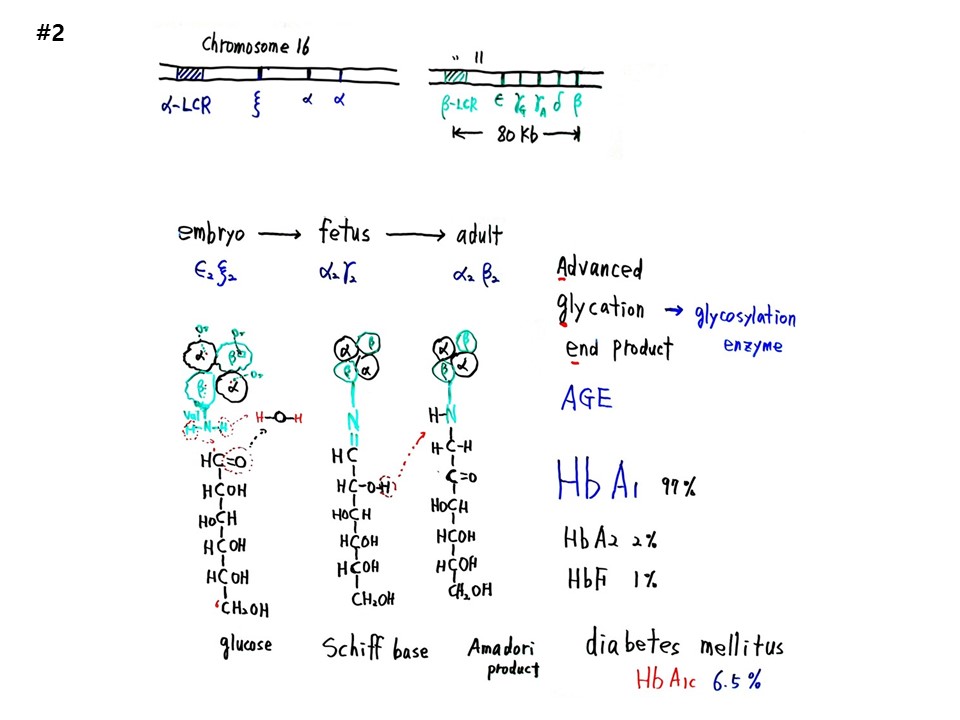
염색체(Chromosome) 16번에 글로빈의 α unit gene, 11번에 β unit gene이 있다. α unit gene은 α-LCR(Local control region), ξ, α, α 부위가 있고, β unit gene은 β-LCR, ε, γG, γA, δ, β 부위가 있다. 유전자가 포함된 부위의 전체 염기수는 80kb로 염기가 8만개이다.
피를 만드는 글로빈 유전자 2개의 unit 조합은 발생에 따라 다르다. 배아(embryo)는 ε2와 ξ2, 태아(fetus)는 α2와 γ2, 성인(adult)은 α2와 β2이다. 발생의 초기로 갈수록 산소획득능력이 더 뛰어난 unit조합이다. 그래서 우리는 산소가 부족한 조건에서도 살 수 있는 본래 능력을 유전자에 가지고 있다.
당뇨병을 검사하기 위한 피검사에서 당화혈색소를 이해해보자. 만일 하루 24시간동안 시간단위로 혈당체크가 가능하다면 먹는 것과 직결된 건강문제를 새롭게 자각할 수 있을 것이다. 헤모글로빈은 500개 아미노산으로 구성되는데, 4개의 Unit에 각각 산소가 1분자씩 결합된다. 포도당(glucose)의 1번 탄소는 알데하이드(CHO)로 되어 있는데, 헤모글로빈 β-unit의 아미노산 Valine의 아미노기(NH2)와 결합하여 C=N 이중결합이 되고, H2와 O는 H2O가 되어 빠져 나간다. 이 화합물을 Schiff base라고 한다. Schiff base의 포도당 2번탄소가 산소(O)와 이중결합이 되면서 떨어져 나간 수소(H) 2개가 N=C이중결합을 N-C 단일결합으로 바꾸면서 질소(N)와 1번 탄소의 남은 팔에 붙는 변형된 화합물을 Amadori product라고 하는데, 이를 당화혈색소(glycated hemoglobin)라고 하고 당뇨병의 주요지표로 쓴다.
입자충돌이 기본이다. 헤모글로빈 2억5천만개가 떠돌아다니다가 포도당과 충돌한다. 효소가 촉매하지 않기 때문에 정확히 포도당 밀도에 비례하므로 지표가 된다. 노화이론의 주목 물질이 AGE(Advanced glycation end products)이다. 포도당과 충돌하여 당화(glycated)된 단백질과 지방을 말하며 노화의 지표가 된다.
포도당 분자의 질량은 수소(H) 질량기준으로 180으로 아미노산 1개의 질량과 비숫하다. 해모글로빈의 4개 unit의 아미노산 개수는 약500개이니, 포도당의 500배 질량이다. 모든 학문은 아보가드로 수를 만난다. 화학과 생물학의 만남이다. 그러면 엔트로피, 시간의 비밀을 알게 되고 노화를 분자레벨에서 알게 된다.
혈색소는 HbA1c, HbA2, HBF 등인데, HbA1c를 당화혈색소라고 하고, 당뇨병은 HbA1c가 6.5%이상일 때를 말한다. 당화혈색소는 한 번 결합하면 3개월 동안 그대로 있기 때문에 3개월 동안의 평균치를 볼 수 있는 주요지표가 된다.
#3
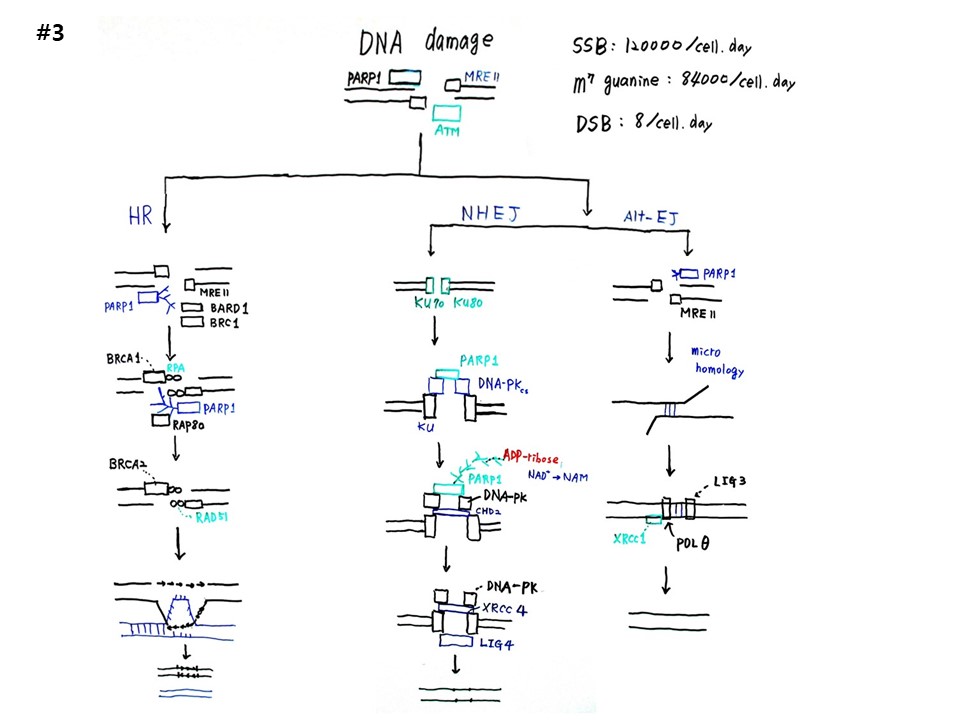
암은 DNA 손상과 관련되어 있다. DNA의 외가닥이 잘려지는 SSB(single strain break)는 세포당 하루에 12만번 일어난다. 그러나 큰 문제가 아니다. 다른 가닥의 염기정보가 있으므로 즉시 수선이 가능하다. G-염기가 메틸화되어 methyl-Guanine이 되는 것은 세포당 하루에 84,000번 일어난다. DNA 이중나선이 모두 잘려지는 DSB(double strain break)는 세포당 하루에 8번 일어나지만 문제는 심각하다. 이중나선 모두 잘려 나가므로 수선하려면 상동염색체에서 염기정보를 찾아내어 HR(homologus recombination, 상동재조합)을 해야 한다. 그런데 상응하는 상동염색체를 찾지 못하면 NHEJ(non-homologus end joining, 비상동말단결합)가 일어난다. 잘려진 끝을 서로 이어 붙이는 임시 땜방이다. 그런데 이것이 잘못된 전사정보를 유출하므로 유방암, 전립선암과 링크된다.
DNA damage 중 DSB(double strain break)의 복구방식인 HR(homologus recombination), NHEJ(non-homologus end joining), Alt-EJ(alternative end joining)를 그림으로 그려보자.
HR 과정은 끊어진 부위에 이중나선 복구단백질인 MRE11(meiotic recombination 11)이 붙는다. 이어서 BARF1, BRC1이 다가오고, PARP1이 PAR가지를 뻗어서 수선을 준비한다. 다음은 BRCA1 (Breast cancer type 1)이 끊어진 나선에 붙어서 RPA(replication protein A)를 붙이고, PARP1은 RAP80(receptor-associated protein 80)을 불러온다. 다음은 BRCA2가 와서 RAD51을 붙인다. 그러면 상동염색체의 DNA 이중나선을 풀어 한 가닥은 위로 올려서 염기복제를 하고, 한가닥은 그대로 있으면 끊어진 DNA가 밑으로 와서 염기복제를 한다. 결과적으로 DNA는 손상이 복구된다.
NHEJ 과정은 끊어진 나선에 Ku70과 Ku80이 붙는다. 다음은 DNA-PK(DNA Dependent Protein Kinase)가 붙고, PARP1이 그 위에 붙는다. 다음은 PARP1에서 PAR가지를 내고, DNA-PK 아래에 CHD2(Chromodomain Helicase DNA Binding Protein 2)가 들어간다. 다음은 CHD2 자리에 XRCC4 (X-ray repair cross-complementing protein 4)가 들어가고, LIG4(DNA Ligase 4)가 붙는다. 최종적으로 끊어진 말단이 이어진다.
Alt-EJ 과정은 끊어진 나선에 MRE11이 붙고 PARP1이 온다. 다음은 절단부의 매우 짧은 microhomology를 기준으로 수선이 일어난다. 다음은 LIG3(DNA Ligase 3)와 POLθ(Polymerase θ)와 XRCC1(X-ray repair cross-complementing protein 1)이 붙어서 수선을 마무리한다.
#4
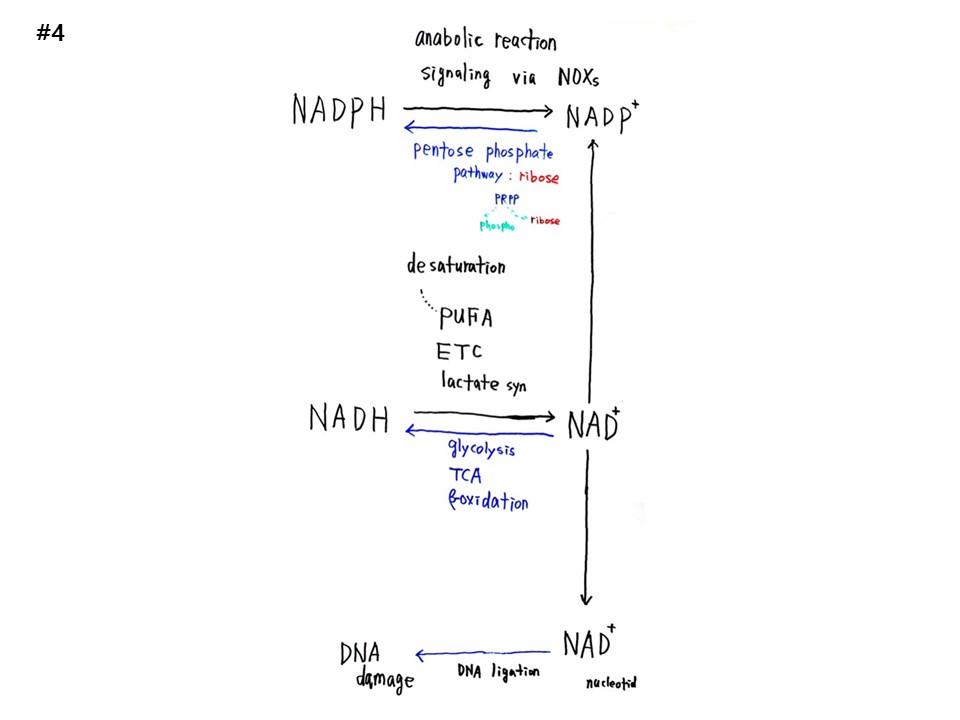
RNA world에는 NAD, PARP, SIRT 모듈이 있다. 세포의 핵에서 NAD는 PARP가 될 수 있다. NAD는 ADP-Ribose와 NAM으로 쪼개진다. ADP-Ribose는 PARP의 AR부위로, PAR가 되면서 세포핵의 타워크레인을 형성한다. 대기의 이산화탄소와 대양의 물을 결합하여 포도당을 만드는 것이 광합성인데 명반응에서 ATP, 암반응에서 NADPH가 나온다. 세포질과 미토콘드리아에서는 NAD와 NADH가 상호변환된다.
NADPH(Nicotinamide adenine dinucleotide phosphate)가 NADP+로 변환되는 과정에 동화작용(anabolic reaction)과 NOXs(NADPH oxidases)를 통한 신호체계가 있다. 반대의 과정에서 오탄당인산경로(pentose phosphate pathway, PPP)가 있는데, 이 경로에서 Ribose가 출현한다.
NADH(Nicotinamide adenine dinucleotide)가 NAD+로 변환되는 과정에 젖산합성(lactate synthesis), 전자전달계(electron transport chain, ETC), 고도불포화지방산(Polyunsaturated fatty acids PUFA)의 탈포화(desaturation)가 있다. 반대과정에 해당과정(glycolysis), TCA회로, β-oxidation이 있다.
NAD+는 NADP+로 갈 수도 있고, AR(ADP-Ribose)로 갈 수도 있다. AR은 핵속에서 PARP1의 가지가 되는데 DNA를 연결하는 DNA damage 복구에 관여한다.
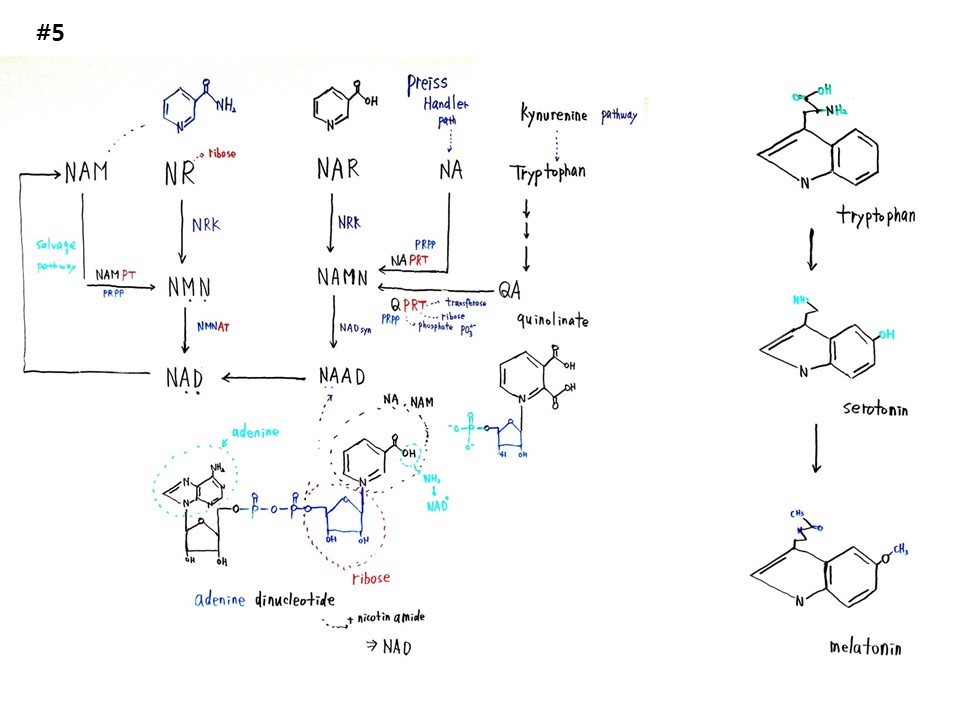
#5
NAM(Nicotine amide)에 Ribose가 붙은 것이 NR(Nicotine amide riboside)이다. NR은 NRK(NR kinase)에 의해 NMN(nicotinamide mononucleotide)이 되고, NMN은 NAD((Nicotinamide adenine dinucleotide)가 된다. NAD는 서투인(SIRT)을 통해 NAM이 된다. 또한 NAM에서 NAMPT(NAM Phosphoribosyltransferase)와 PRPP(phosphoribosyl pyrophosphate)를 통해 NMN이 된다. 이 경로를 구제경로(salvage pathway)라고 한다.
NAM의 -NH2 대신에 -OH가 붙으면 NA(nicotine acid)가 된다. NA에 Ribose가 붙은 것이 NAR(nicotine acid riboside)이다. NRK에 의해 NAMN(nicotine acid mononucleotide)가 되고, NAD synthase에 의해 NAAD(nicotine acid adenyl dinucleotide)가 된다. NAAD는 NAD가 될 수 있다. NA에서 PRPP와 NAPRT(Nicotinate Phosphoribosyltransferase)에 의해 NAMN이 된다. 이를 Preiss-Handler pathway라고 한다. 아미노산 Tryptophan에서 여러경로를 거쳐 QA(quinolinate)가 되고, QA에서 QPRT(Quinolinate Phosphoribosyltransferase)에 의해 NAMN이 된다. 이를 kynurenine pathway라고 한다.
트립토판(tryptophan)에서 조금만 변형되면 세로토닌(serotonin)과 멜라토닌(Melatonin)이 된다.
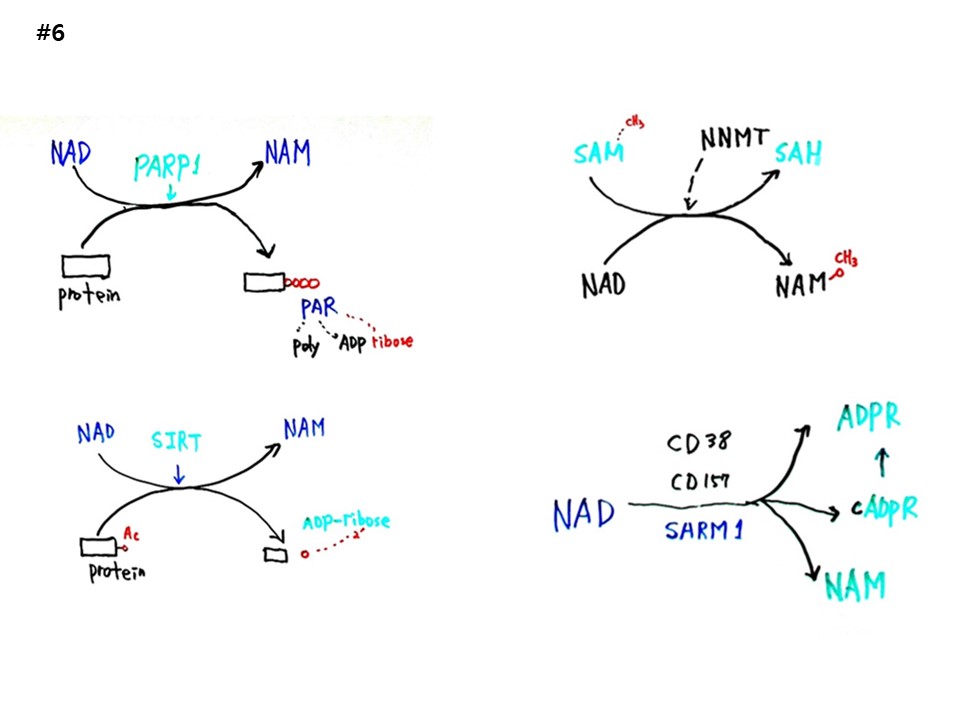
#6
NAD world의 실질편이다. 1) NAD에 PARP1이 동작하여 NAM이 되면서, 단백질에 AR(ADP-Ribose)를 붙여주어 PAR(poly AR)을 형성한다. 2) NAD에 SIRT가 동작하여 NAM과 AR이 되면서 단백질에 붙은 아세틸기를 떼어준다. 아세틸기는 AR의 ribose에 붙는다. 3) SAM(S-adenosylmethionine)의 메틸(CH3)이 NNMT가 동작하여 SAH(S-Adenosyl-L-homocysteine)가 되고 NAD가 NAM이 되면서 메틸이 떨어져 나간다. 4) NAD에 CD38, CD159, SARM1이 동작하여 ADPR, cADPR, NAM이 된다.
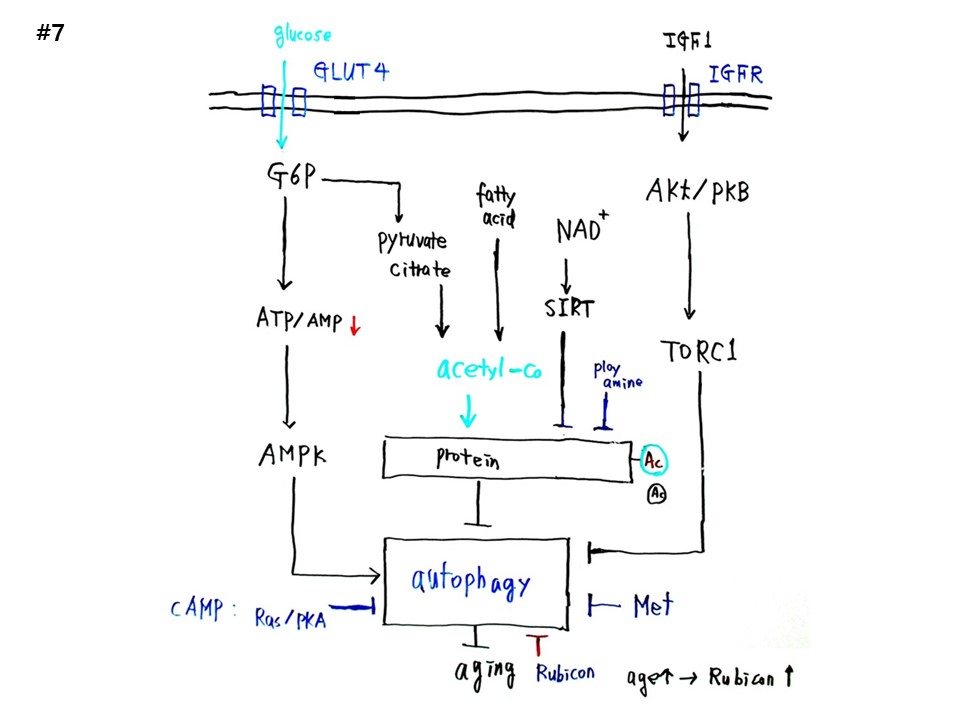
#7
오토파지(Autophagy) 그림이다. 오토파지는 무조건 좋은 것이다. 피부미용, 간헐적 단식의 효과와 관련된다. 일본 이세신궁은 20년마다 새로 짓는다. 그래서 항상 건물이 새롭다. 오토파지도 이런 방식이다.
포도당(glucose)이 GLUT4 채널을 통해 세포막 안으로 들어오면 G6P(glucose 6-phosphate)를 거쳐 피루브산(Pyruvate)이 되는 해당과정(Glycolysis)을 통해 ATP가 생산된다. ATP는 에너지로 사용되면서 인산(P) 2개가 떨어져 나가서 AMP로 전환되는데, 간헐적단식과 운동으로 AMP전환율이 높아져 ATP/AMP 비율이 낮아지면, AMPK(AMP kinase)가 활성화되어 오토파지를 촉진한다.
한편, 미토콘드리아 TCA회로애서 피루브산과 시트르산(Citrate)에서 Acetyl-CoA가 만들어지고, β-Oxidation을 거치는 지방산(fatty acid)에서도 많은 Acetyl-CoA가 만들어진다. Acetyl-CoA는 단백질에 아세틸기를 붙이는데, 아세틸기가 붙은 단백질은 오토파지를 억제한다. 이때 NAD+와 함께 동작하는 SIRT가 단백질에 아세틸기를 떼어주면 오토파지가 촉진이 된다. 또한 콩, 버섯에 많이 함유된 폴리아민(polyamine)은 아세틸화된 단백질을 억제하여 오토파지를 촉진한다.
세포막의 IGFR 채널로 들어온 인슐린성성장인자(Insulin like growth factor 1, IGF1)는 Akt/PKB를 활성화하고 Akt/PKB는 TORC1(The target of rapamycin kinase complex I)을 활성화하면, TORC1은 오토파지를 억제한다.
아미노산인 Methionine도 오토파지를 억제하고, 나이들면 많아지는 루비콘(Rubicon)도 오토파지를 억제한다. Ras/PKA (cAMP-dependent protein kinase)도 오토파지를 억제한다.
오토파지는 노화를 억제한다. 따라서 오토파지를 억제하면 노화가 촉진된다. 싱클레어 교수의 서투인과 함께 오토파지는 노화의 최신이론이다.


노트를 통해서 다시한번 정리하니까 많은 도움이 됩니다
헤모글로빈의 대해서도 예전 강의때 보다 더 정갈하게 정리해주신 박사님의 강의를 보면서
감탄을 합니다
이제 AC등이 글이 보이네요^^
역시 예습이고 반복노출이고 손의 움짐임등 몸이 말할때까지 훈련뿐인것 같습니다.
[바이오사이언스]는 우리가 왜 세포를 알아야 하는지 현대 생명과학의 과학적사고를 가지게 하는것 같아요
감사히 복습 잘하겠습니다 감사합니다^^